| Гостевая | yurishmukler@yahoo.com | Ю. Б. Шмуклер | Галерея | О себе | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Новости | Летопись текстов | Из дальних странствий | Моя семья и другие звери | |||||||||
| Биологическое | ЦСКА | Друзья и родственники | Генеалогия | Бреды и анекдоты | ||||||||
|
||||||||||||
|
Тез. докл. Международной конференции "Рецепторы и внутриклеточная сигнализация” 24-26 мая 2011г., г. Пущино , том 1, с. 291-295 ПАТТЕРН ЭКСПРЕССИИ РЕЦЕПТОРОВ СЕРОТОНИНА В ЭМБРИОГЕНЕЗЕ XENOPUS LAEVIS Никишин Д.А.1, Кремнёв С.В.2, Шмуклер Ю.Б.1 1Институт биологии развития им. Н.К. Кольцова РАН, Москва 2Московский государственный университет им. М.В. Ломоносова, Москва
Донервные функции веществ, описанных как нейротрансмиттеры (серотонин, ацетилхолин, адреналин, дофамин), впервые были показаны более 50 лет назад [1,2]. С тех пор стало ясно, что эти вещества функционально активны в течение всего онтогенеза, от гаметогенеза до постэмбрионального развития, а нейротрансмиттерная роль этих веществ является вторичной. В частности, серотонин вовлечен в самые разнообразные процессы индивидуального развития, от оогенеза и оплодотворения до морфогенетических процессов и таких явлений постэмбрионального периода, как метаморфоз [3,4]. Кроме того, известно, что серотонин влияет на такие функции клетки, как ресничная моторика [5] и состояние цитоскелета [6,7]. Серотонин обнаружен в яйцеклетках и ранних зародышах всех исследованных на этот предмет животных [8]. Показано, что материнский серотонин, накопленный в яйцеклетке, критически необходим для нормального морфогенеза плода у мышей [9]. Кроме того, имеются многочисленные экспериментальные данные, полученные физиологическими методами и демонстрирующие, что серотонин участвует в таких процессах раннего развития, как дробление [10], межбластомерные взаимодействия [11], гаструляция [12] и установление лево-правой асимметрии [13]. Долгое время описание функций нейротрансмиттеров в эмбриогенезе ограничивалось физиологическими методами. Лишь в последнее время появились исследования трансмиттерных систем в донервном эмбриогенезе, выполненные с использованием молекулярно-биологических методов, но они до сих пор остаются единичными [14,15]. Данная работа посвящена исследованию экспрессии рецепторов и транспортёров серотонина в эмбриогенезе шпорцевой лягушки Xenopus laevis, и является частью систематического исследования донервных трансмиттерных систем в раннем развитии животных.
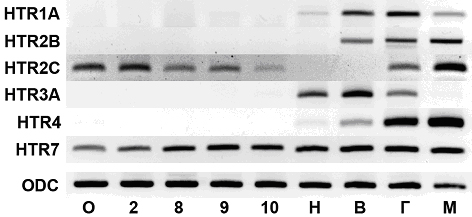
Методом обратно-транскрипционной ПЦР (ОТ-ПЦР) мы исследовали паттерн экспрессии рецепторов серотонина HTR1A, HTR2B, HTR2C, HTR3A, HTR4 и HTR7. В качестве внутреннего контроля использовали ген орнитиндекарбоксилазы (ODC). ОТ-ПЦР проводили на тотальной РНК, выделенной из неоплодотворённых ооцитов и эмбрионов на стадиях двух бластомеров (стадия 2), средней бластулы (стадия 8), поздней бластулы (стадия 9), ранней гаструлы (стадия 10), нейрулы (стадия 16) и вылупления (стадия 33-35), в качестве положительного контроля были получены пробы головастиков и мозга взрослых лягушек, стадии определяли по таблицам нормального развития [16]. Результаты преставлены на рис.1. ОТ-ПЦР анализ показал, что HTR1A, HTR2B, HTR3A и HTR4 не экспрессируются на ранних стадиях развития X. laevis. HTR1A выявляется начиная с нейрулы, также как HTR3A и HTR4. HTR2B впервые выявляется только на стадии вылупления. HTR2C экспрессируется на донервных стадиях, выявляется начиная с зиготы, до стадии 10, на стадиях нейрулы и вылупления не выявляется. Вновь HTR2C начинает экспрессироваться на стадии головастика. HTR7 экспрессируется непрерывно на всех стадиях развития. Все рецепторы серотонина экспрессируются во взрослом мозге, кроме HTR3A. ПЦР-продукты HTR2C и HTR7, полученные из проб ооцитов выделены и отсеквенированы. Полученные нуклеотидные последовательности соответствуют мРНК HTR2C и HTR7 X. laevis.
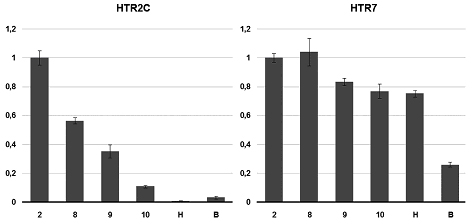
Экспрессию рецепторов HTR2C и HTR7 мы количественно исследовали методом ПЦР в реальном времени, результаты представлены на рис.2. Оба гена экспрессируются на ранних стадиях развития, что говорит об их материнском происхождении, поэтому расчёт степени экспрессии производили относительно стадии 2 бластомеров, т. е. относительно материнской экспрессии гена. Экспрессия HTR2C максимальна на стадии 2 бластомеров, после чего постепенно снижается. К стадии 10 степень экспрессии составляет чуть больше 10%, на стадиях нейрулы и вылупления – менее 3%. HTR7 экспрессируется более или менее равномерно на протяжении всего развития, лишь на стадии вылупления его экспрессия уменьшается примерно в три раза. Зиготический геном Xenopus включается на стадии средней бластулы (стадия 8), когда происходит так называемый среднебластульный переход и в зародыше начинается транскрипция. Раннее развитие происходит за счёт транскриптов, входящих в состав материнской мРНК, накопленных во время оогенеза [17]. Мы показали, что в состав материнского пула мРНК входят транскрипты по крайней мере двух из семи типов серотониновых рецепторов. Во-первых, начиная с яйцеклетки и по крайней мере до гаструляции экспрессируется HTR2C. На стадиях нейрулы и вылупления экспрессия настолько мала, что не выявляется методом ОТ-ПЦР при 35 циклах амплификации, а на стадии головастика экспрессия HTR2C появляется снова. То, что максимум экспрессии HTR2C приходится на самые ранние стадии развития, говорит о его участии в наиболее ранних процессах эмбриогенеза. Показано, что ритансерин, антагонист HTR2A и HTR2C, индуцирует растворение зародышевого пузырька в незрелых ооцитах [18]. Возможно, что HTR2C участвует в регуляции созревания яйцеклетки. Второй рецептор серотонина, экспрессирующийся на ранних стадиях развития – HTR7. Он выявляется на протяжении всего эмбрионального развития. Есть данные, свидетельствующие о влиянии HTR7 на процесс созревания ооцитов X. laevis [18]. Однако, судя по динамике экспрессии в эмбриогенезе, можно предполагать о какой-то универсальной регуляторной роли этого рецептора в развитии. На ранних стадиях не выявляется экспрессия HTR1A, HTR2B, HTR3A, HTR4. Для HTR1A показано участие в нейрогенезе, для HTR2B – в черепно-лицевом морфогенезе, формировании челюстного сустава и морфогенезе глаза у Xenopus [19]. Эти процессы происходят на поздних стадиях развития. Что касается раннего эмбриогенеза, то физиологическими методами показано, что серотонин участвует в установлении лево-правой асимметрии X. laevis. Предполагается, что эта функция опосредована рецепторами серотонина HTR3 и HTR4 [13]. Однако, наши данные чётко свидетельствуют о том, что транскрипты HTR3A и HTR4 не входят в состав материнской мРНК и появляются только после гаструляции. HTR3 является лиганд-зависимым ионным каналом, состоящим из пяти субъединиц, которых существует несколько типов, причём функциональный третий рецептор обязательно имеет в своем составе субъединицу HTR3A. Следовательно, отсутствие экспрессии HTR3A говорит об отсутствии функциональных третьих рецепторов. Это же справедливо и для мономерного HTR4. Не исключено, что эти рецепторы нарабатываются во время оогенеза и представлены в эмбрионах в виде белка. Таким образом мы показали, что на ранних стадиях развития Xenopus экспрессируются по крайней мере два рецептора серотонина. Существенно, что эти рецепторы сопряжены с разными системами вторичных мессенджеров. HTR2C через Gq активирует фосфолипазу C, поэтому его взаимодействие с серотонином приводит к повышению внутриклеточного Ca2+. При этом, кроме всего прочего, активация кальций-зависимой протеинкиназы С имеет множество эффектов на цитоскелет [20], которые могут опосредовать влияние серотонина на деления дробления. Связавшийся с лигандом HTR7 через Gs активирует аденилатциклазу, что приводит к повышению уровня цАМФ. Этот сигнал также имеет множество последствий – известны эффекты цАМФ на цитоскелет [21], и даже на закладку осевого комплекса [22]. Стоит отметить, что мы показали экспрессию мРНК этих рецепторов, что не означает экспрессию самого белка. Тем более, что само по себе присутствие транскрипта в составе материнской мРНК не гарантирует, что он будет транслирован на ранних стадиях. Однако, динамика экспрессии этих генов, а так же известные эфекты серотонина в раннем развитии, позволяют предполагать, что эти рецепторы функционально активны в этот период эмбриогенеза. Известно, что в ранних эмбрионах Xenopus присутствует серотонин. Его концентрация серотонина падает во время гаструляции и вновь увеличивается уже на нейральных стадиях развития [13]. Такая динамика указывает на то, что серотонин функционально активен именно в донервном развитии. Наши результаты показали, что эти функции могут быть опосредованы через экспрессирующиеся на ранних стадиях развития рецепторы серотонина HTR2C и HTR7. Стоит отметить, что серотонергическая система не является единственной возможной сигнальной системой, функционирующей в раннем эмбриогенезе Xenopus. Известно, что в ранних эмбрионах лягушки есть адреналин и норадреналин и экспрессируется адренорецептор ?1 [23]. Это демонстрирует множественность трансмиттерных систем в эмриогенезе, постулированную Бузниковым [2,8]. Данная работа является первой частью систематического исследования трансмиттерных систем в раннем эмбриогенезе. Работа поддержана грантом РФФИ № 08-04-00144. ЛИТЕРАТУРА 1. Манухин Б.Н., Бузников Г.А. // Физиологический журнал СССР. (1960) (9): 1160-3.2. Бузников Г.А. Низкомолекулярные регуляторы зародышевого развития. М.: Наука. (1967).3. Turlejski K. // Acta Neurobiol. Exp. (1996) 56 (2): 619-36.4. Barlow L.A., Truman J.W. // J. Neurobiol. (1992) 23 (7): 829-44.5. Doran S.A., Koss R., Tran C.H., Christopher K.J., Gallin W.J., Goldberg J.I. // J. Exp. Biol. (2004) 207 (8): 1415-29.6. Small D.H., Wurtman R.J. // Proc. Natl. Acad. Sci. USA. (1984) 81 (3): 959-63.7. Бузников Г.А., Григорьев Н.Г. // Ж. эвол. биохим. физиол. (1990) (26): 614-22.8. Бузников Г.А. Нейротрансмиттеры в эмбриогенезе. М.: Наука. (1987).9. Cote F., Fligny C., Bayard E., Launay J.-M., Gershon M.D., Mallet J., Vodjdani G. // Proc. Nat. Acad. Sc. U. S. (2007) 104 (1): 329–34.10. Buznikov G.A., Nikitina L.A., Raki? L.M., Milosevi? I., Bezuglov V.V., Lauder J.M., Slotkin T.A. // Brain Res. Bull. (2007) 74 (4): 221-31.11. Shmukler Y.B., Silvestre F., Tosti E. // Zygote. (2008) 16 (1): 79-86.12. Мартынова Л.Е. // Онтогенез. (1981) 12 (3): 310–4.13. Fukumoto T., Kema I.P., Levin M. // Curr. Biol. (2005) 15 (9): 794-803.14. Hamdan F.F., Ungrin M.D., Abramovitz M., Ribeiro P. // J. Neurochem. (1999) 72 (4): 1372-83.15. Dube F., Amireault P. // Life Sci. (2007) 81 (25-26): 1627-37. 16. Nieuwkoop P.D., Faber J. Normal Table of Xenopus laevis (Daudin). 17. Heasman J. // Development. (2006) 133 (7): 1205-17. 18. Sheng Y., Wang L., Liu X.S., Montplaisir V., Tiberi M., Baltz J.M., Liu X.J. // J Cell Physiol. (2005) 202 (3): 777-86. 19. Reisoli E., De Lucchini S., Nardi I., Ori M. // Development. (2010) 137 (17): 2927-37. 20. Larsson C. // Cell Signal. (2006) 18 (3): 276-84. 21. Howe A.K. // Biochim. Biophys. Acta. (2004) 1692 (2-3): 159-74.22. Kim M.J., Han J.K. // Mech Dev. (1999) 89 (1-2): 55-64. 23. Devic E., Paquereau L., Steinberg R., Caput D., Audigier Y. // FEBS Lett. (1997) 417 (2): 184-90.
|